共有結合の結晶について知りたい
ダイヤモンド型結晶がよくわからない
今回はこのような悩みを解決します。
苦手意識を持つ人の多いダイヤモンド型結晶について、図を使ってわかりやすく解説しているのでぜひ参考にしてください。
プロフィール

目次
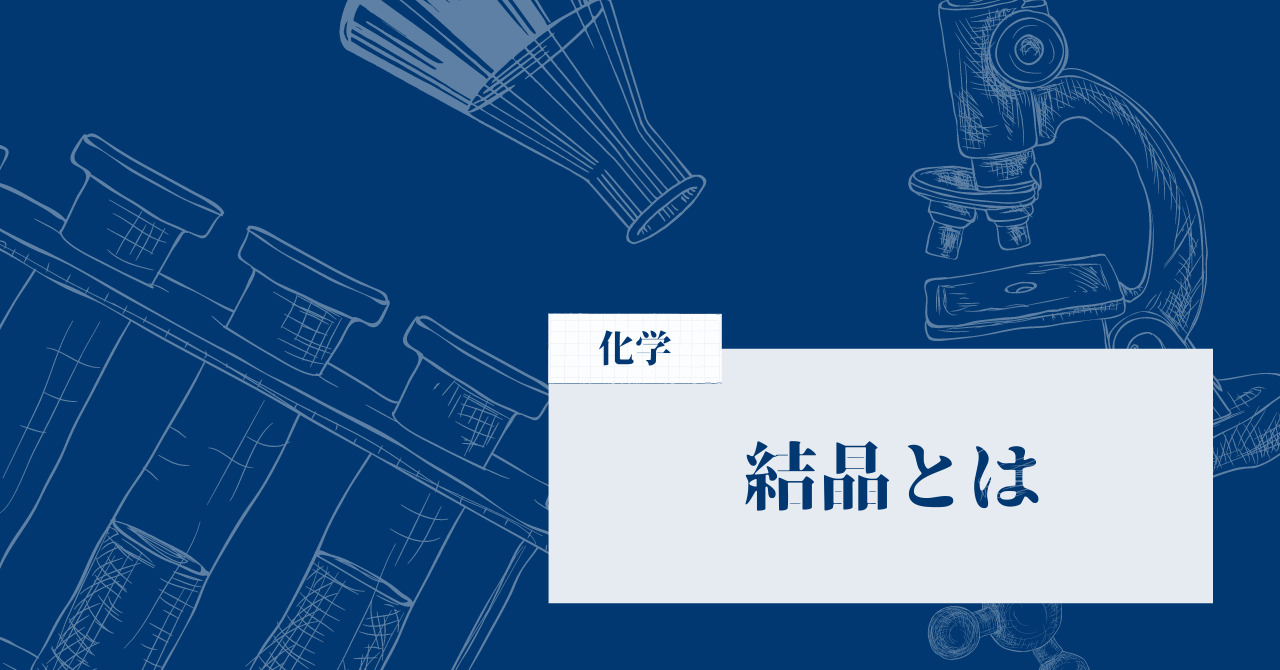
共有結合結晶の結晶格子
まずは結晶格子の説明に行く前に、共有結合結晶について確認しておきましょう。
そもそも結晶には4つの種類があります。金属結晶・イオン結晶・分子結晶・共有結合結晶の4つです。そして今回はそのうちの共有結合結晶について、結晶格子すなわち原子の並び方を見ていくというわけです。
他の金属結晶などでは同じ結晶の中でも複数の結晶格子がありましたが、共有結合結晶に関しては冒頭で述べた通りダイヤモンド型しかありません。下の図で概要を理解しておきましょう。
なお、共有結合結晶と分子結晶というのはいずれも共有結合を含みますが、全くの別物です。これら2つの違いをわかっていない受験生が多いので、気になる方はこちらを参考にしてください。共有結合結晶についても詳しく説明しています。
ダイヤモンド型結晶格子
ここからは、具体的にダイヤモンド型結晶格子についてみていきたいと思います。
なお、ダイヤモンド型結晶格子において重要なポイントは他の結晶格子と同様、配位数・含有粒子数・原子半径と1辺の関係・充填率となります。
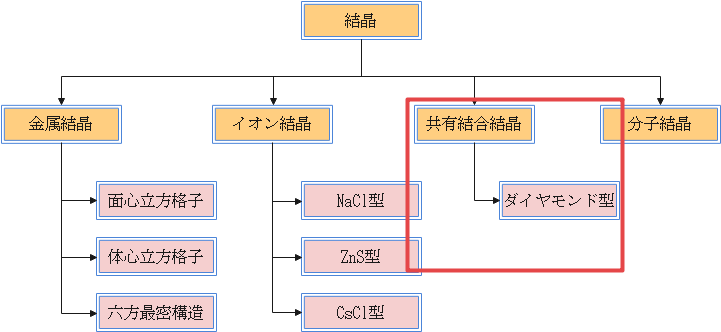
ダイヤモンド型結晶格子は次の図のようになります。面心立方格子と同じところに原子が配置されている他、1/8の立方体の中心にも1つ飛ばしで原子が存在しています。
イオン結晶の結晶格子の1つであるZnS型のイオンを全てC原子に置き換えたものと考えることができますね。
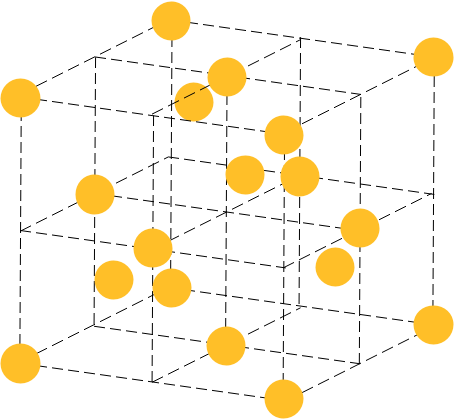
配位数に関してですが、1/8の立体を取り出すと容易に4であることがわかります。
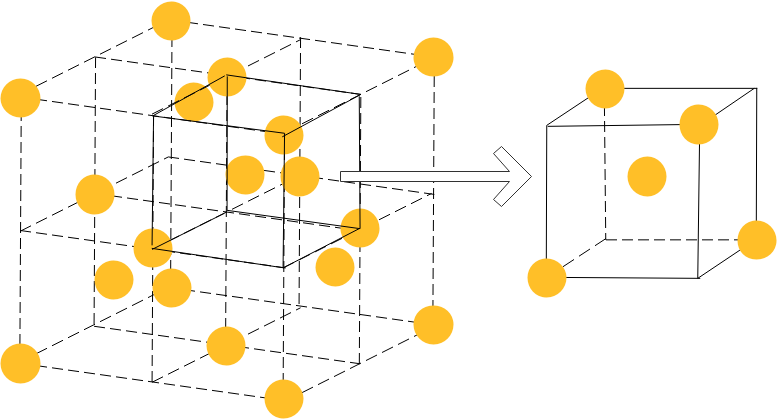
また、含有粒子数については、面心立方格子の位置に4つ、1/8の立方体の中心に4つ原子があるので、この結晶格子全体では8個の原子が含まれていることになります。
では次に、原子半径と格子の1辺の関係について考えてみましょう。これを求める際は原子同士が接している断面を切り出すのが基本的なやり方でしたね。
なお、ダイヤモンド型はZnS型同様、1/8の立方体を切り出すのがポイントです。また、考えやすいように補助的に原子を追加している点も同様です。
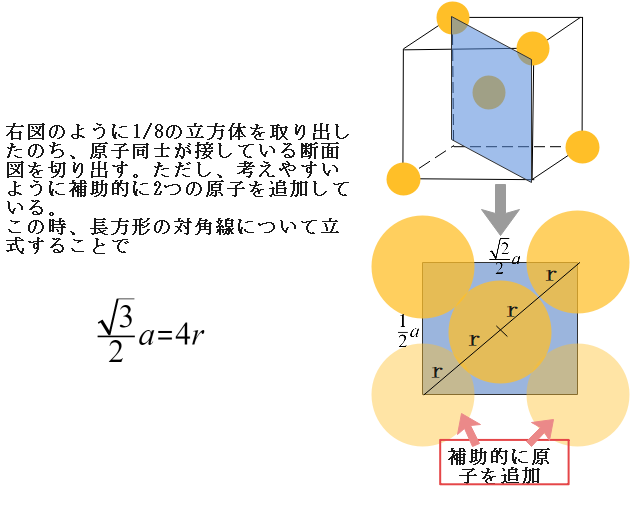
あとは最後にダイヤモンド型結晶格子の充填率を求めましょう。充填率は以下のように求められるのでしたね。
充填率の求め方
充填率=原子の体積の合計÷結晶格子の体積
したがって結晶格子中には原子が8つ含まれますから、計算は次のようになります。
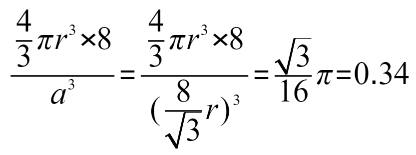
これより、ダイヤモンド型結晶格子の充填率は34%ということになります。
まとめ
今回はダイヤモンド型結晶格子について説明しました。
実際に学習してみると、金属結晶・イオン結晶とやることは同じだと気づくことができたのではないでしょうか。原子半径と格子1辺の長さを求めるところではいくつか解き方にポイントがあるので、特に重点的に反復しておきましょう。
最後まで読んでいただきありがとうございました。それではまた!