イオン結晶の結晶格子にはどのようなものがあるか、皆さんご存知ですか。
おそらくですが、パッと思いつかないという人がほとんどなのではないでしょうか。そうなってしまうのも仕方がありません。結晶格子というと、どうしても金属結晶の結晶格子が思い浮かびますからね。
ただ実は、金属結晶の陰に隠れてはいますが、イオン結晶の結晶格子も非常に重要で試験でよく出るのです。したがって、金属結晶同様、イオン結晶の結晶格子についてもしっかりと学習しておかなければなりません。
そこで今回はイオン結晶の結晶格子について解説していきます。
なお、そもそもイオン結晶とは何かがわからない方は先にこちらで復習しておきましょう。
また、限界半径比についての定義や考え方はこちらで解説しています。
プロフィール

目次
イオン結晶の結晶格子
さて、まずはイオン結晶の結晶格子の概要を整理しましょう。
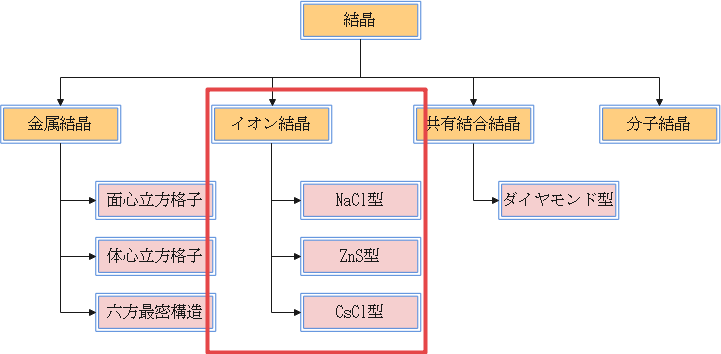
結晶にはそもそも4種類あり、そのうちの1つがイオン結晶になりますね。そしてイオン結晶中の原子というのは無秩序にではなく、規則的に並んでいます。
そのイオン結晶中の原子の並びを可視化したものがイオン結晶の結晶格子ということになります。
また、図にもある通りイオン結晶の結晶格子にはいくつか種類が存在します。そのうちの代表的なものが NaCl型・ZnS型・CsCl型 になります。他の型についてはあまり試験で問われることは少ないのでこの3つだけ押さえておけば十分です。
そしてイオン結晶の結晶格子について学習する際に覚えておかなくてはならないことは配位数・含有粒子数・イオン半径と格子の1辺の関係・限界半径比の4つです。
結晶格子の全体像や配位数などの用語については次の記事を参考にしてください。
NaCl型
ここからは具体的な結晶格子について説明していきます。まずはイオン結晶の結晶格子の中でも最もメジャーなNaCl型についてです。
NaCl型は次の図のように陽イオンと陰イオンが交互に並んでいます。
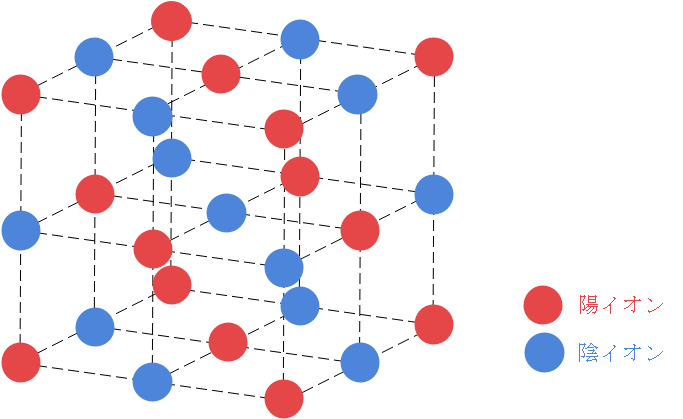
まずは配位数を確認しましょう。今回はイオン結晶であるため、陽イオンと陰イオンそれぞれについて考える必要があるので注意してください。
中心の陰イオンに注目すると、近接する陽イオンは6個あることがわかりますね。また、NaCl型というのは陰イオンと陽イオンを入れ替えても同じ構造になるので、陽イオンについても配位数は6になると言えます。
では次に、含有粒子数を考えてみましょう。陽イオンと陰イオンはそれぞれ何個ずつ入っているでしょうか。
イオンがごちゃごちゃしていてわからないという方もおられるかもしれませんが、陽イオンだけに注目してみてください。何か見えてきませんか。
そうです。陽イオンだけを取り出すと、なんと金属結晶の面心立方格子と同じ配置をしているんですね。
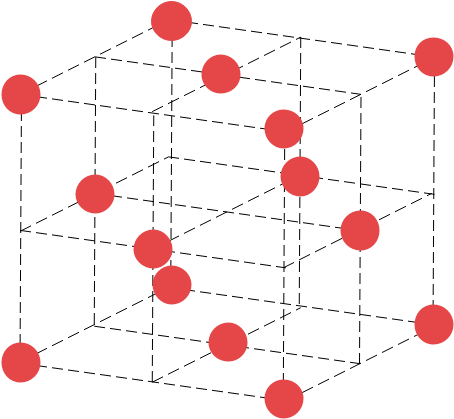
したがって、陽イオンはちょうど4個含まれていることになりますね。ということは、陰イオンについても同様に4個含まれていると考えることができます。
面心立方格子の含有粒子数の求め方については次の記事を参考にしてください。
次に、格子の1辺とイオン半径の関係式を求めてみます。
図を見るとわかる通り、1辺には陽イオン半径2つ分と陰イオン半径2つ分が含まれているので、次のようになります。
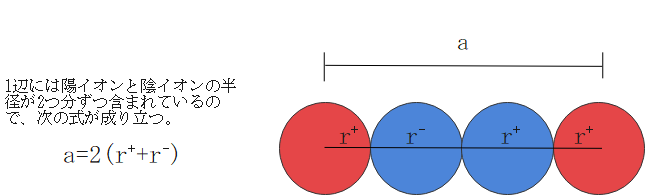
では最後に限界半径比を求めてみましょう。限界半径比を求めるには、まずは原子同士が接している面を切り出す必要があります。その後陰イオンを大きくしていき、陰イオン同士が接する瞬間の図を描きます。
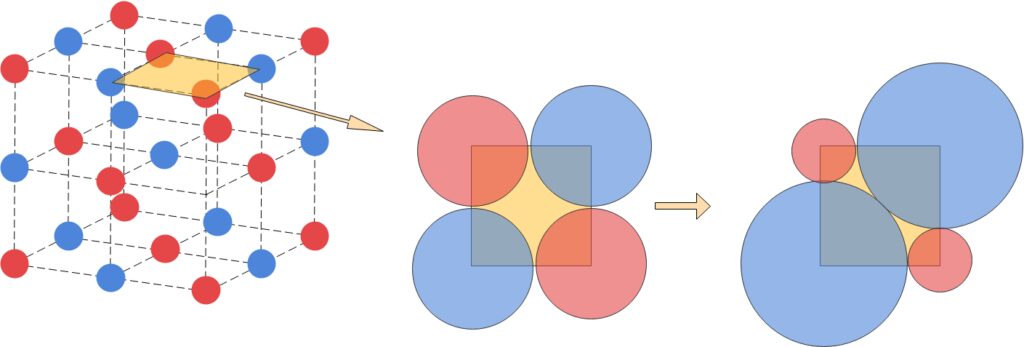
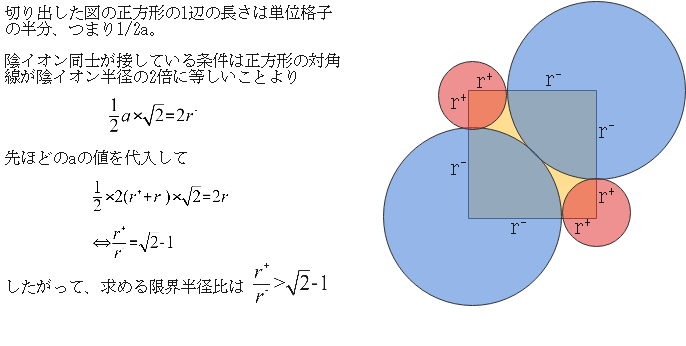
あとは陰イオン同士が接する瞬間について、辺とイオン半径の関係式を立式することで限界半径比は求まります。
CsCl型
続いて、CsCl型の結晶格子について説明します。
CsCl型の結晶格子は非常にシンプルで、立方体の中心に陽イオン、各頂点に陰イオンが配置されます。金属結晶の体心立方格子と配置は一緒です。
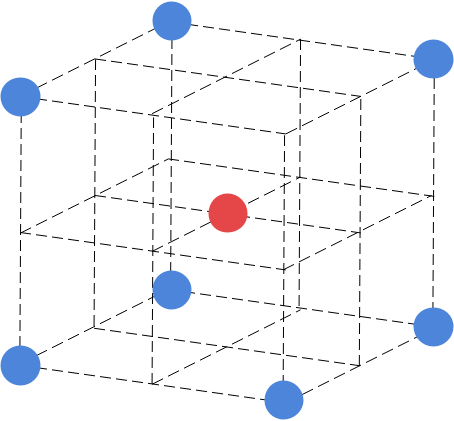
CsCl型の配位数ですが、陽イオンを中心に見ると8であることがわかります。一方の陰イオンを中心に見た場合ですが、CsCl型も陽イオンと陰イオンを入れ替えても同じ構造になるので配位数は8となります。
含有粒子数は簡単に求まりますね。陽イオンは中心に1つ、陰イオンは各頂点に1/8の原子がいるので、陰イオンもやはり1つです。
続いて、格子の1辺とイオン半径の関係式を求めてみましょう。陽イオンと陰イオンが接している面を切り出し、次のように考えます。
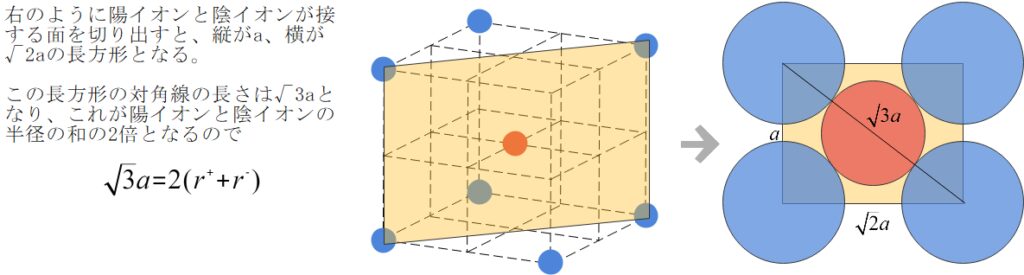
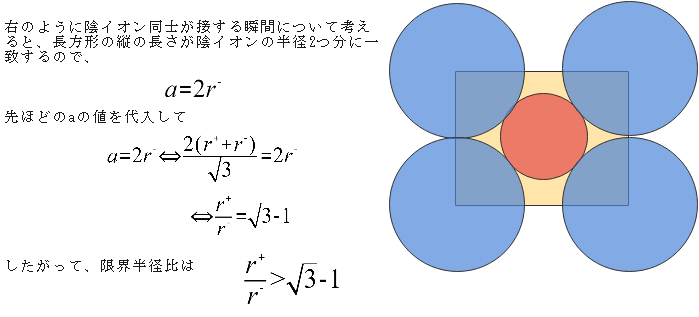
最後に、限界半径比を求めたいと思います。陰イオンを大きくしていき、陰イオン同士が接する瞬間について考えるのでしたね。
ZnS型
最後に説明するのはZnS型です。
ZnS型は下の図のようになっており、NaCl型・CsCl型と比べると少し複雑です。
陰イオンに注目すると、面心立方格子と同じ配置をしているのがわかりますね。一方の陽イオンですが、図が少しごちゃついてはいますが、1/8の立方体の中心に1つ飛ばしで配置されています。
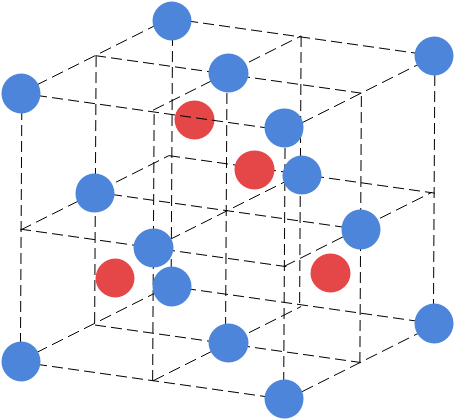
配位数に関しては、まず陽イオンに注目しましょう。陽イオンを中心に見ると、陽イオンは1/8の立方体の中心にいて、最近接の陰イオンはその立方体の頂点に4つ存在することがわかります。したがって、陽イオンの配位数は4です。
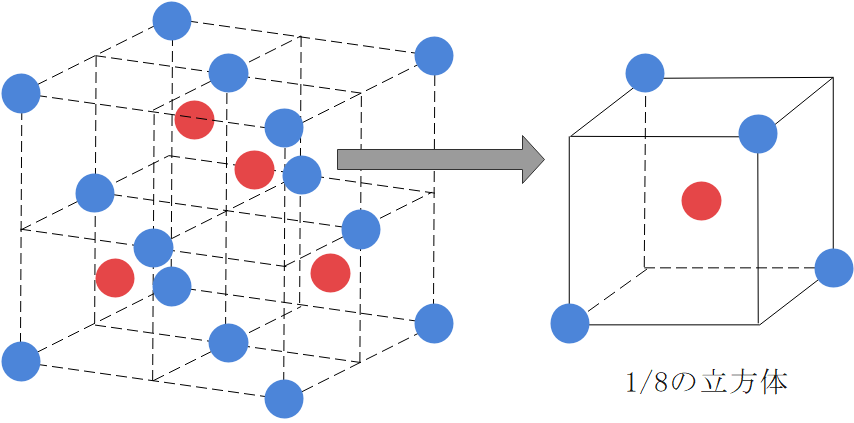
一方陰イオンに注目した場合ですが、陰イオンが含まれる1/8の立方体2つにつき1つの最近接した陽イオンが存在します。したがって、陰イオンは8個の1/8立方体に含まれているので、配位数は4となります。
この説明でわからないという方は、面心立方格子の時同様に2つの格子を並べ、陰イオンを中心に持ってくるとわかりやすいと思います。
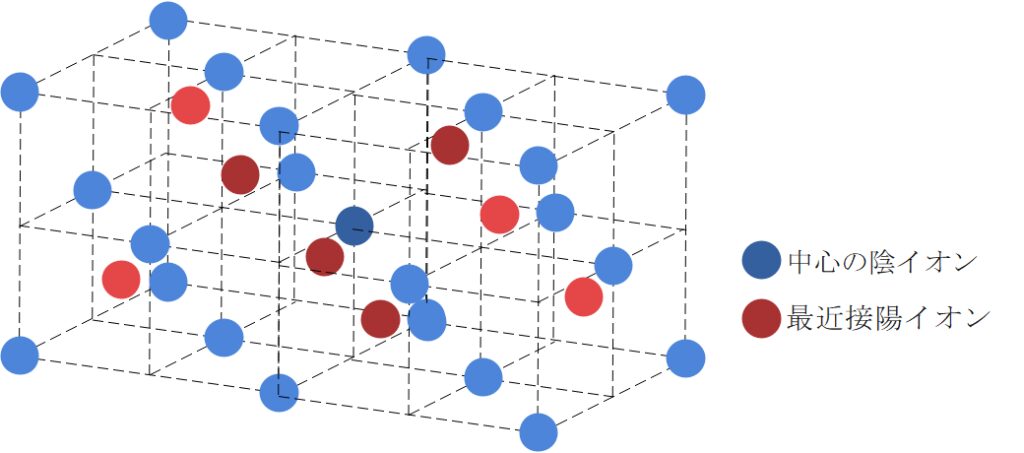
続いて含有粒子数について考えてみましょう。陽イオンは明らかに4個ですね。陰イオンに関しては面心立方格子と同じですので、陰イオンはこの格子中に4個含まれていることがわかります。
では次に、イオン半径と格子の1辺の関係式を求めます。これまで同様、イオン同士が接している面を切り出します。
ただし今回は、先に陽イオンが含まれる1/8の立方体を取り出してから接している面について考えます。なお、本来は陰イオンは切り出した面に2つしか含まれていませんが、関係式を求めやすくするため補助的に2つの陰イオンを付け加えています。数学の補助線のようなものだと思ってください。
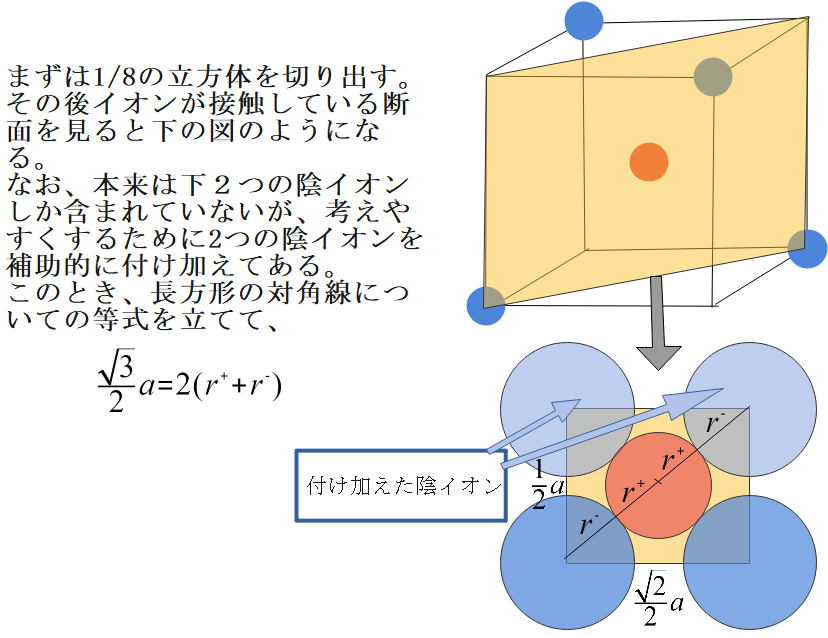
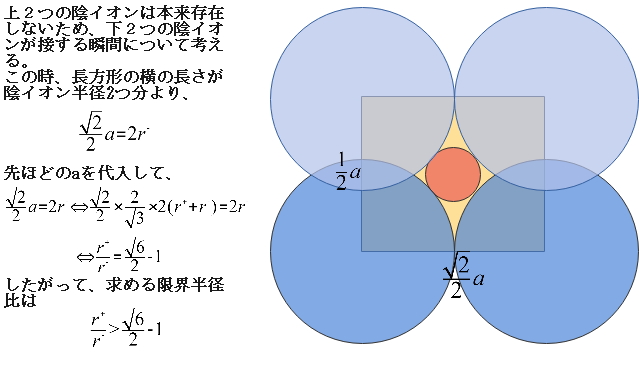
最後に、ZnS型の限界半径比を求めましょう。先ほどの断面図で陰イオンを大きくし、陰イオン同士が接する瞬間について考えます。
ただし、補助的に加えた陰イオンは本来存在していないので、下2つの陰イオンが接する瞬間を考えます。
まとめ
今回はイオン結晶の結晶格子について解説しました。
この分野で最も大事なのは限界半径比の求め方です。ノーヒント状態でも解けるようにしておきましょう。
配位数や含有粒子数などは金属結晶の結晶格子でも扱うため、合わせて覚えてしまうとよいと思います。
最後まで読んでいただき、ありがとうございました。それではまた~。