
pHに苦手意識がある

pH計算は複雑でわかりにくい
歩兵もみなさんのようにpH計算に対する苦手意識があり、試験に出るたびに毎回白紙答案を提出していました…。
しかし受験勉強を通じて歩兵はpH計算の攻略の方法に気が付きました。
pH計算攻略の鍵はいたってシンプル。
4つのパターンを暗記しましょう。
pH計算が苦手な原因というのは全体像が把握できていないことなんですよね。
pH計算の方法には何があるのかをそもそも知らないために、毎回計算の仕方で悩むことになるのです。
でももう大丈夫です。これから紹介する4つのパターンを覚えてしまえばpHなんて楽にクリアできるようになりますよ。
プロフィール

目次
pH計算は4つのパターンがある
早速ですが、pH計算の4つのパターンを紹介します。
pH計算4つのパターン
- 強酸(強塩基)のpH
- 弱酸(弱塩基)のpH
- 緩衝液のpH
- 弱酸の塩のpH
まずpH計算は大きく分けると2つに分類できます。
それは強酸(強塩基)のpHと弱酸(弱塩基)が関わるpHの2つです。
そしてさらに弱酸(弱塩基)が関わるpHが弱酸(弱塩基)のpH・緩衝液のpH・弱酸の塩のpHの3つに分類できます。
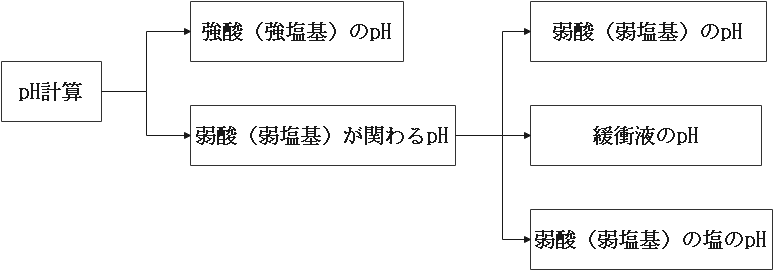
こうしてpH計算は4つのパターンに分類することができます。
ここからは4つのパターンについて、具体的なpHの求め方を見ていきます。
強酸(強塩基)のpH
強酸(強塩基)のpHは次のように求めます。

どうしてこの式で求められるのかや強酸の中和反応が関わる場合のpHの求め方についてはこちらの記事で詳しく解説しています。
弱酸(弱塩基)のpH
では次に弱酸(弱塩基)のpHの求め方です。

単純にpHや水素イオン濃度を求められただけであればこの公式を用いて構いません。
しかし、この公式を導くところから導出させる問題も多く出題されます。
どのようにしてこの公式が導かれるのかについては次の記事でよく確認しておきましょう。
緩衝液のpH
続いて紹介するのは緩衝液のpHです。
ここで、pH計算に行く前に緩衝液とは何かについて復習しておきましょう。
緩衝液とは、弱酸とその塩(または弱塩基とその塩)が同時に存在する水溶液のことを指すのでしたね。
例えば酢酸と酢酸ナトリウムが同時に存在する水溶液は代表的な緩衝液です。
緩衝液…弱酸とその塩(または弱塩基とその塩)が同時に存在する水溶液
では緩衝液はどのようにつくられるでしょうか。
基本的に緩衝液というのは中和反応によって作られます。
先ほどの例であれば、酢酸水溶液に水酸化ナトリウムを加えることで緩衝液になりますね。
ここで大切なのは緩衝液ができる条件です。どれくらいの水酸化ナトリウムを加えたら緩衝液になるでしょうか。
答えは酢酸の物質量が水酸化ナトリウムの物質量を上回る時になります。
緩衝液になるには酢酸と酢酸ナトリウムが同時に存在する必要がありましたね。これを満たすためには酢酸の方が水酸化ナトリウムよりも多い必要があるというわけです。
緩衝液となる条件は「弱酸のmol > 強塩基のmol」または「弱塩基のmol > 強酸のmol」が成り立つこと。
ここまでで緩衝液についての前提が理解できたと思うので、緩衝液のpHの求め方を紹介したいと思います。

これについても公式として覚えてしまうのがよいと思います。
この公式については導出が問われることはないとは思いますが、なぜこんなに簡単な式になるのかを知っておくとより公式の意味が分かると思うので、ぜひ次の記事も参考にしてください。
弱酸(弱塩基)の塩のpH
最後に弱酸(弱塩基)の塩のpH計算方法をご紹介します。
弱酸(弱塩基)の塩について少し説明しておきましょう。
弱酸(弱塩基)の塩の水溶液はどのようにしてつくられるでしょうか。
もちろん初めから塩を水溶液に溶かすという方法もあります。しかしそれよりも大切なのは中和反応においてどのようにできるかです。
実は中和反応の過程で弱酸(弱塩基)の塩の水溶液ができるのは中和点の一瞬だけです。
つまり弱酸(弱塩基)のmolと中和に使う塩基(酸)のmolが一致したときに塩の水溶液というのはできるんですよね。
弱酸(弱塩基)の塩の水溶液ができる条件は「弱酸のmol = 塩基のmol」または「弱塩基のmol = 酸のmol」が成り立つこと。
例えば酢酸を水酸化ナトリウムで中和する際は酢酸と水酸化ナトリウムの物質量が等しくなった瞬間だけ、酢酸ナトリウムの水溶液だと言えますね。
この条件はぜひ覚えておいて下さい。
緩衝液の条件と合わせて覚えておけば、問題を見た際にどのパターンのpH計算方法をとればよいかがすぐに判断できるようになります。
それではこの条件を踏まえて、弱酸(弱塩基)の塩のpHの計算方法を見てみましょう。

水のイオン積というものが出てきましたね。これはよく出てくるので覚えておきましょう。
水のイオン積というのは水素イオン濃度と水酸化物イオン濃度の積は一定の値になるという原理原則です。
一般的には次のように定義されています。
弱酸の塩のpHの公式の導出方法についても解説は行っていますが、おそらく知らなくても大丈夫だと思います。
公式を使ってサクッと答えを求めてしまいましょう。興味のある方は覗いてみてください。
>>弱酸(弱塩基)の塩のpHについてもっと詳しく
まとめ
今回はpH計算の4つのパターンについて解説しました。
今回紹介した内容をすべて理解できていれば、pH計算はもう楽勝です。
試験などで正しく公式を使うためにも何度も読み返して知識を定着させてください。
それでは、これからも勉強頑張ってください。
歩兵は皆さんの志望校合格を応援しています(*^_^*)
おすすめ記事















