突然ですが皆さん、結合と結晶の違いはわかりますか。おそらくほとんどの人がそれらの違いをあやふやに覚えているのではないかと思います。
というか、そもそも結合とは何か、結晶とは何かすらうまく説明ができない人もいるのではないでしょうか。
しかし、それらを知らないからと言って恥ずかしく思う必要はありません。歩兵も現役時代はちゃんと理解できておらず、浪人してやっ結合と結晶について説明できるようになりました。
そこで今回は、結合と結晶の違いにも触れながら結合について説明していきたいと思います。
最後まで読んだころには、きっと完璧に理解できているはずです。
プロフィール

目次
結合と結晶の違いとは
結合の詳しい説明に行く前に、まずは結合と結晶の違いについて理解しておきましょう。
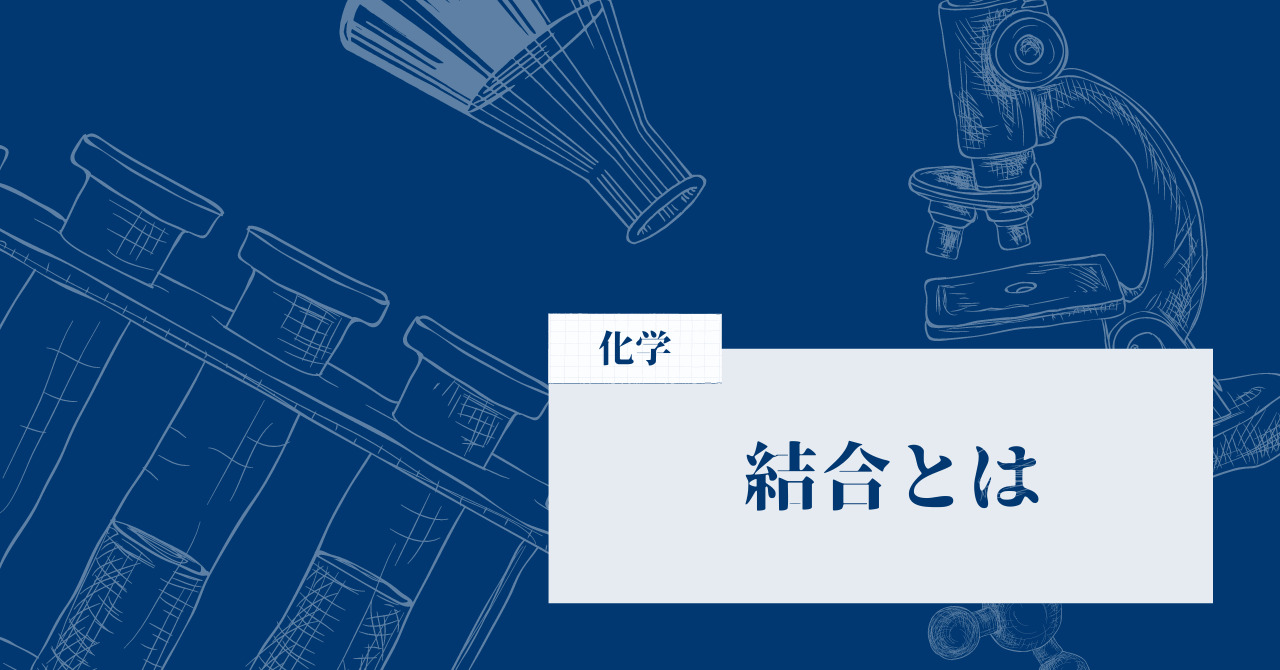
結合と結晶の違い、それは2つの原子間のものか、3つ以上の原子間のものかという違いです。
そもそも結合というのは、2つの原子が存在し、それらが電子を介して結びついていることを指します。したがって、2つの原子間にあるものが結合と言えます。
一方の結晶というのは、3つ以上の原子が結合を介して結びつき、立体を形成していることを指します。言い換えると、2原子間の結合が繰り返されることで多数の原子が立体的につながったものが結晶ということです。
以上のことから、結合は2つの原子間のものであり結晶は3つ以上の多数の原子でできたものだということができます。結合の集まりが結晶ということですね。
結合と結晶というのはこのように単純なものなのですが、意外とごちゃまぜに覚えてしまっていたのではないでしょうか。
結合とは
結合は3種類
先ほども書きましたが、結合というのは2つの原子が電子を介して結びついていることを指します。
そしてその電子の状態によって、結合というのは3つに分類されています。なお、ここで言う電子の状態とは、結合を作っている電子が原子間でどのように配置されているかだと考えてください。
では、電子の状態はどのように決まるのでしょうか。そこで重要になってくるのが電気陰性度です。
電気陰性度とは、各原子が結合を媒介している電子をどれほど自分の方に引き付けるかの度合です。どれくらい電子が好きかを表す尺度だと説明されることもあります。
電気陰性度…各原子が結合を媒介する電子をどれほど自分の方に引き付けるかの度合
結合というのは2つの原子間のものだと説明しました。そして、2つの原子の電気陰性度がどれほどかによって電子の状態が変わってくるというわけです。
具体的には共有結合、金属結合、イオン結合の3つです。
共有結合
まずは電気陰性度が大きいもの同士が結び付く場合、いずれの原子も電子を引き付けようとしますから、電子はたいだい結合の真ん中に位置します。この様子が、2つの原子が電子を共有しているように見えることから、この場合の結合を共有結合と呼びます。
なお、電気陰性度が大きい元素は非金属元素と考えてよいので、共有結合とは非金属元素同士の結合だということができます。
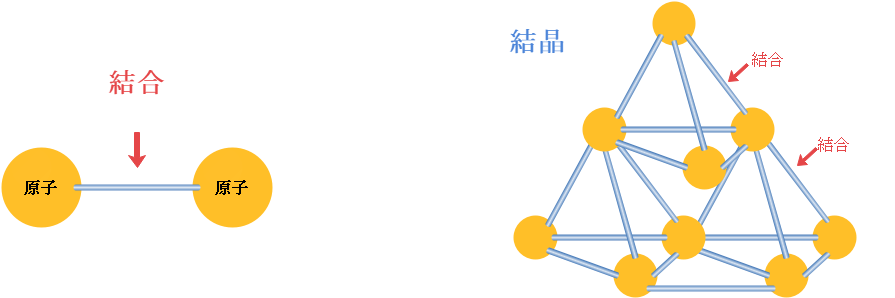
共有結合の例としては 、HClやCH4などがあります。
ここで、共有結合に関する用語を確認しておきましょう。
電子を2個セットで電子対と言いますが、電子対には2種類あります。もともと対になっていたものと、結合したことで対になったもの、すなわち結合に使われている電子対の2つです。
このうち後者は共有されている電子対であることから共有電子対、一方の前者はその反対で非共有電子対と呼ばれています。覚えておきましょう。
イオン結合
電気陰性度の大きいものと小さいものによる結合もあります。この場合は電気陰性度の差が非常に大きいです。そのため、電子は電気陰性度の大きい原子側に大きく引き付けられていることになりますね。
この場合はもう、電気陰性度が大きい原子は電子が多い陰イオン状態、小さい原子は電子が少ない陽イオン状態になっています。したがって、イオン同士の結合ですのでイオン結合と呼ばれます。
イオン結合の例としては、NaClやCuOなどがあります。
金属結合
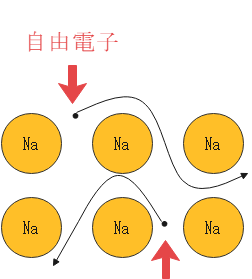
電気陰性度が小さいもの同士が結びつく場合はどうでしょう。いずれの原子も電子を欲しがらないので、電子は居場所がなく原子の周りをぐるぐると回ることになります。このような電子は自由電子と呼ばれます。
そしてその自由電子によって結びつく結合は金属結合と呼ばれます。金属=電気陰性度が小さいですから、電気陰性度が小さいもの同士の結合が金属結合と呼ばれるのも当然ですね。
金属結合の例としてはNaやCuなどが挙げられます。
このように分類するとあたかも3つの結合は別物に見えますが、あくまでも結合というのは電子を介して2つの原子が結びついているという点で同じものです。便宜的に3つに分類して性質等を分析しているというだけです。
電子が中途半端に引き付けられている場合などは、限りなく共有結合に近いイオン結合のような状態もあり得るというわけですね。
まとめ
今回は結合について解説しました。今回の内容の中でも重要なポイントを挙げておきます。
- 結晶と結合の違いとは
- 結合の3種類とは
- 結合の3種類は何を基準に分類されているか
これらを理解したうえで結晶についての記事を読んでいただければ、結合と結晶についてさらに深く理解できると思います。
最後まで読んでいただきありがとうございました。
それではまた!