
緩衝液って何?
緩衝液のpHの求め方が知りたい
今回はこのよう悩みを解決します。
最後まで読んでいただければ緩衝液について完璧に理解できますよ。
プロフィール

目次
緩衝液とは
緩衝液の定義、それは弱酸とその塩、または弱塩基とその塩が同時に存在している水溶液となります。
意外とシンプルですよね。
例えば有名な弱酸である酢酸を例に考えてみますと、酢酸の塩として酢酸ナトリウムがあげられます。
したがって、酢酸と酢酸ナトリウムが同時に存在する水溶液は緩衝液と言えるわけです。
ポイント
緩衝液とは弱酸とその塩(または弱塩基とその塩)が同時に存在する水溶液をさす
緩衝液の特徴
緩衝液には非常に重要な特徴があります。
それは、緩衝液に強酸や強塩基を加えてもそのpHはほとんど変化しないというもの。
普通に考えると塩酸を加えたら水溶液は酸性に、水酸化ナトリウムを加えてら水溶液は塩基性に傾きそうですよね。
しかし緩衝液の場合、強酸や強塩基を少し加えたくらいではpHは変化しないのです。
ポイント
緩衝液に強酸や強塩基を加えてもpHはほとんど変化しない
なぜこの特徴が重要なのかというと、世の中にはpHがころころと変わっては困るものがたくさんあるからです。
例えば我々の血液。実は緩衝液でできています。
仮に緩衝液でなかったらどうでしょうか。
何かの拍子に血液に酸や塩基が入り込んだ場合、pHに急激な変化が起こり大変なことになってしまうことは容易に想像がつくでしょう。
緩衝液のpHが保たれる仕組み・理由
続いて緩衝液のpHが変化しにくい理由を説明します。
緩衝液のpHが安定する理由はズバリ、加えられた水素イオンや水酸化物イオンを打ち消す反応が起こるからです。
では実際に起こる反応を先ほどの酢酸と酢酸ナトリウムの緩衝液を例に見てみましょう。
緩衝液の反応
・強酸(H+)を加えた場合
CH3COO- + H+ → CH3COOH
・強塩基(OH-)を加えた場合
CH3COOH + OH- → CH3COO- + H2O
2つの式を見てもらえばわかると思いますが、 H+やOH-を加えても反応によって消えてしまうんですよね。
そのため、緩衝液では酸や塩基を加えてもpHに変化が起こりにくくなっています。
ポイント
緩衝液では加えたH+やOH-を打ち消す反応が起こるのでpH変化が起きにくい
なお、1つ目の式は酢酸の電離におけるルシャトリエの原理で説明できます。
\(CH_{3}COOH \rightleftharpoons CH_{3}COO^{-} + H^{+}\)
酢酸は上のような電離平衡状態を保っています。そこへH+を加えるとどうなるでしょうか。
ルシャトリエの原理から、平衡は左へ移動しますね。それを表したのが1つ目の式になります。
また、2つ目の式ですがこれは単純な中和です。OH-を加えたら酸である酢酸が中和されるという反応式になります。
緩衝液のpHの求め方
では緩衝液について理解できたところで緩衝液のpHの求め方を解説します。
結論から言うと、次の公式を覚えてください。

緩衝液のpHは毎回必ずこのパターンで解けます。
実際に緩衝液のpHを求めてみよう
本当に紹介した公式で解けるのか、実際の問題を通じて確認してみましょう。
問題
酢酸と酢酸ナトリウムの混合溶液があり、酢酸の濃度は1.0×10-3(mol/L)、酢酸ナトリウムの濃度は1.0×10-3(mol/L)である。この溶液のpHを求めよ。ただし、酢酸の電離定数をKa=1.8×10-5、log102=0.30、log103=0.48とする。
これまでは電離式を書いて、電離平衡の式に文字を代入して…とやみくもに解き進めていたと思いますが、公式を知った皆さんはもう一瞬で解けますね?
解答
緩衝液のpHより、
[H+]=[CH3COOH]×Ka/[CH3COO-]=(1.0×10-3×1.8×10-5)÷1.0×10-3=1.8×10-5
したがって、pHは
pH=-log10[H+]=-log101.8×10-5=6-log1018=6-log102-2log103=4.74
いかがですか。公式さえ覚えていれば緩衝液のpHはこんなにも簡単に求まるのです。
緩衝液のpHの公式の導出
それでは最後に、緩衝液のpHの公式がどのように導かれるのかを説明します。
導出方法自体知る必要はないのですが、どうしてこの公式が使えるのかを知っておくことは公式を暗記する手助けになるので覚えておいて損はないと思います。
酢酸の濃度がCa(mol/L)、酢酸ナトリウムの濃度がCb(mol/L)である水溶液を例に考えます。
まずは初期状態からの平衡移動を考えてみましょう。
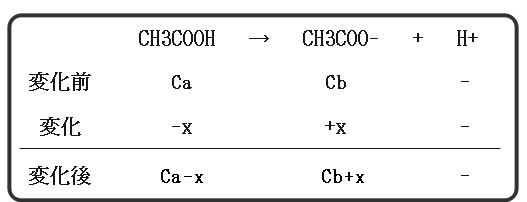
本来であればここからこれらの値を電離定数に代入し、xを求めます。しかし、非常に大変ですね。
そこで登場するのが近似になります。
緩衝液ではpH変化が起こりにくいと説明したと思いますが、言い換えると平衡移動がほとんど起こらないということです。
つまり、xはほとんど0に近いということが言えます。
[CH3COOH]=Ca、[CH3COO-]=Cbが成り立つというわけですね。
ポイント
緩衝液のpH計算では、緩衝液の性質から平衡移動は起こらないと考え、近似する
あとはこれを電離定数に代入して変形すれば、次のように[H+]が求まります。
Ka=[CH3COO-][H+]/[CH3COOH]=Cb[H+]/Ca ⇔ [H+]=Ca・Ka/Cb
今の話が少し難しいと感じた方は、極端ですが次のように考えて問題ないと思います。
「緩衝液では、平衡状態における弱酸および弱酸の塩の濃度は初期濃度と変わらない」
まとめ
今回は緩衝液とは何か、そして緩衝液のpHの求め方について説明しました。
緩衝液は苦手とする人が多いからこそ、得意にしてしまえば差をつけることができます。
何度も読み返してぜひ完璧に理解して下さい。












