
鉛蓄電池の仕組み、反応式がわからない
鉛蓄電池の計算問題の解き方がわからない
今回はこのような悩みを解決します。
プロフィール

目次
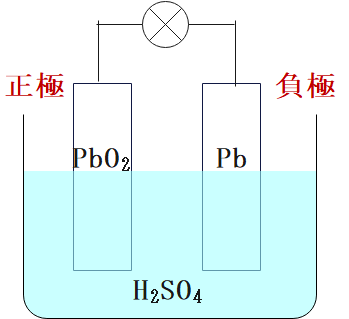
鉛蓄電池とは
鉛蓄電池とは、正極に酸化鉛(PbO2)、負極に鉛(Pb)を用いた電池です。
水溶液には硫酸が使われています。
特徴として、充電することで再利用できる2次電池であることが挙げられます。なお、充電と放電については後ほど詳しく説明します。
ここで正極・負極と出てきましたが、陽極陰極との違いがよくわかっていない方は電気分解についてもあわせて復習しておきましょう。
鉛蓄電池の仕組み・反応式の書き方・覚え方
次に、鉛蓄電池の反応の仕組みを見ていきます。
正極、負極それぞれで見ていきますが、いずれの極からもPb2+が出てくるというのがポイント。同じものが出てくると知っているだけで少し覚えやすくなります。
正極での反応
正極では酸化鉛が電子を受け取って還元され、鉛イオンに変化します。
正極の反応
PbO2 +2e- +4H+ → Pb2+ + 2H2O
一見するとこれで半反応式が完成したように見えるのですが、実はPb2+をPbSO4に変えるという作業が残っています。
なぜこの作業が必要かというと、Pb2+は水溶液に含まれるSO42-と反応して難溶性塩であるPbSO4となってしまうからです。無機化学の沈殿のところで学習したのではないでしょうか。
したがって、先ほどの両辺にSO42-を加えた次の半反応式が完成版になります。
正極の半反応式
PbO2 + 4H+ + SO42- +2e- → PbSO4 + 2H2O
負極での反応
一方、負極では鉛が溶解して電子を放出します。
負極の反応
Pb → Pb2+ + 2e-
ただし、正極同様これで完成とはいきません。
溶解した鉛イオンは水溶液中の硫酸イオンと結合して難溶塩を形成しますから、次のようになります。
ポイント
Pb + SO42- → PbSO4 + 2e-
反応式のまとめ方
では最後に、正極と負極の反応式をまとめてみましょう。
なお、反応式のまとめ方はこちらの半反応式のまとめ方のところで詳しく解説しています。
あわせて読みたい
半反応式をまとめる際は電子の数が揃うようにするのでしたね。
今回ははじめの段階でそろっていますから、そのまま足せばよいです。そしてその結果が次のようになります。
鉛蓄電池の全体の反応
Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
放電と充電の違い・反応式
では次に、放電と充電の違いおよびそれぞれにおける反応式について解説します。
まず放電ですが、これは鉛蓄電池から電気を取り出すことを指します。実際に電池として利用しているということですね。
そしてこの時の反応式は先ほど作ったものと同じになります。
放電時の反応式
Pb + PbO2 + 2H2SO4 → 2PbSO4 + 2H2O
したがって、放電した場合は各極板に硫酸鉛が析出することから質量が増加します。
質量増加に関する問題はよく出てくるので知っておきましょう。
一方の充電ですが、これは放電の逆すなわち電気をためることを指します。このように充電可能な電池のことを2次電池というので覚えておいてください。
そして充電の時の反応は放電時の逆反応になります。
充電時の反応式
2PbSO4 + 2H2O → Pb + PbO2 + 2H2SO4
なお充電のやり方ですが、この反応からもわかる通り、負極には電子を流し正極にはからは電子を取り出す必要があります。
したがって、充電時は外部電源の正極を鉛蓄電池の正極に、負極を鉛蓄電池の負極に接続することになります。
ここのつなぎ方は非常にややこしく、試験で問われることもあるので正確に覚えておきましょう。
まとめ
今回は鉛蓄電池について解説しました。
鉛蓄電池は苦手意識を持つ受験生が多いですが、一度反応式や仕組みを覚えてしまえば意外とすんなり解けてしまいます。
ぜひ今回の内容を何度も復習して鉛蓄電池を攻略してください。













