
弱酸の塩のpHの求め方がわからない
今回はこのような悩みを解決します。
弱酸の塩のpHをを求められる受験生は本当に限られています。
しかし、公式さえ覚えてしまえば誰でもpHなんて一瞬で求められてしまいます。公式を手に入れて上位層の仲間入りをしてください。
プロフィール

目次
弱酸(弱塩基)の塩のpHの求め方・公式
弱酸と弱塩基は本質的には同じ考え方で解けるため、ここからは弱酸の塩にしぼって説明していきます。
では早速公式をご紹介します。
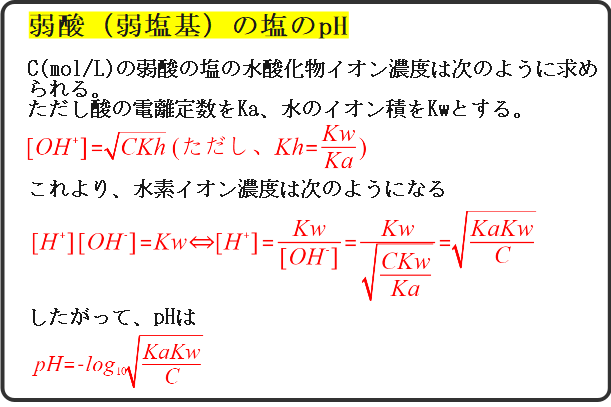
多少複雑かもしれませんが、この公式を使えばpHは簡単に求めることができます。
逆に言うと、この公式が使えないとおそらく計算が煩雑すぎて解けません。
弱酸(弱塩基)の塩のpHを実際に求めてみよう
では、公式が本当に使えるのか問題を使って試してみましょう。
問題
1.0×10-2(mol/L)の酢酸ナトリウムのpHを求めよ。ただし、酢酸の電離定数Kaを1.8×10-5、水のイオン積Kwを1.0×10-14とする。
必要であればlog102=0.3、log10=0.48を使ってもよい。
今までは手も足も出なかったかもしれないこの問題も、もう皆さんなら簡単に解けますね?
弱酸の塩のpHから、
\([OH^{-}]=\sqrt{\frac{CKw}{Ka}}\)
\(=\sqrt{\frac{1.0×10^{-2}×1.0×10^{-14}}{1.8×10^{-5}}}=\frac{1.0×10^{-5}}{3\sqrt{2}}\)
したがって、水素イオン濃度は
\([H^{+}]=\frac{Kw}{[OH^{-}]}=\frac{1.0×10^{-14}}{\frac{1.0×10^{-5}}{3\sqrt{2}}}=3\sqrt{2}×10^{-9}\)
これより、pHは
\(pH=-log_{10}[H^{+}]=-log_{10}3\sqrt{2}×10^{-9}\)
\(=9-log_{10}3-\frac{1}{2}log_{10}2=9-0.48-0.15\)
\(=8.37\)
このようになります。
弱酸(弱塩基)のpHの公式の導出
最後に弱酸(弱塩基)のpHの公式の導出方法について説明します。
導出方法が問題で問われることはないと思いますが、知っておくと公式を忘れてしまっても自分で作り出せるので便利です。
余裕のある方は導出方法も覚えておきましょう。
まず弱酸の塩、今回でいう酢酸ナトリウムは次のように電離します。
\(CH_{3}COOH → CH_{3}COO^{-} + H^{+}\)
続いて起こる反応が塩の加水分解です。この反応が起こるから弱酸の塩のpHは塩基性に寄ることになります。
\(CH_{3}COO^{-} + H_{2}O → CH_{3}COOH + OH^{-}\) …★
さて、ここでポイントになるのがこの加水分解を1価の弱塩基の電離式だとみなすということです。
つまり、酢酸イオンが1価の弱塩基で電離によって\(OH^{-}\)を放出したと考えるのです。
このように考えるメリットは、弱酸(弱塩基)のpHの公式が使えるというところにあります。
弱酸(弱塩基)のpHの公式についてはこちらを参考にしてください。
★の式の電離定数をKhとすれば、濃度がC(mol/L)の酢酸ナトリウムのOH^{-}濃度は次のようになります。
\([OH^{-}]=\sqrt{CKh}\)
では次に、★の式の電離定数Khを考えてみましょう。定義に従えば次のようになります。
\(Kh=\frac{[CH_{3}COOH][OH^{-}]}{[CH_{3}COO^{-}]}\)
ここで、分子と分母に\([H^{+}]\)をかけて整理してみます。
\(Kh=\frac{[CH_{3}COOH]}{[CH_{3}COO^{-}][H^{+}]}×[H^{+}][OH^{-}]\)
実はこれ、すでに知っている数値であるKaとKwを使って表せるんですよね。Khというのは次のようになります。
\(Kh=\frac{1}{Ka}×Kw=\frac{Kw}{Ka}\)
したがって、[OH-]は次のように求められます。
\([OH^{-}]=\sqrt{CKh})(Kh=\frac{Kw}{Ka}\)
ここまで求めることができれば、あとは水のイオン積を用いて\([H^{+}]\)を求め、最後にpHを出します。
最後のpHを求めるところまでまとめると次のようになるというわけです。

まとめ
今回は弱酸(弱塩基)の塩のpHの求め方を解説しました。
はっきり言って、自力で解くのは不可能です。今回のやり方を覚えて、いざ問題に出会ったときに瞬殺できるようにしましょう。
おすすめ記事














