
飽和蒸気圧って何?
飽和蒸気圧曲線の見方がわからない
飽和蒸気圧や水銀柱の計算がわからない
今回はこのような悩みを解決します。
飽和蒸気圧に関連する悩みはほぼ全て今回の記事で解決すると思いますので、ぜひ参考にしてください。
プロフィール

目次
飽和蒸気圧とは
飽和蒸気圧とは一言で言うと、ある温度において気体の蒸気圧がとれる最大値となります。
このように言われたところでよくわからない人もいるかと思うので、もう少し補足していきます。
気体になれる量は決まっている
まず知っておいて欲しいのが、気体になれる量は決まっているということです。
例えば密閉容器に水を入れたとすると、しばらくは蒸発が進むので液体の水は減っていきますが、どこかで水が減らなくなります。
つまりそれ以上気体にはなれないということなんですね。

ポイント
密閉容器で気体になれる量は決まっている
では、いったいどれくらいの量まで気体になることができるのでしょうか。
それを決定するのがまさに飽和蒸気圧なのです。
蒸気圧と飽和蒸気圧の違い
では飽和蒸気圧によって気体になれる量が決まるとはどういうことでしょうか。
まずは前提として蒸気圧について知っておきましょう。
蒸気圧とは、気体の圧力のことを指します。つまり一般的な圧力とほぼ同義です。
ただし、この蒸気圧には限界があります。その限界値が飽和蒸気圧と呼ばれているわけですね。
ポイント
蒸気圧とは気体の圧力と同義である。そしてその蒸気圧の限界値を飽和蒸気圧という。
つまり、水などの液体は蒸気圧が飽和蒸気圧になるまでしか気体になることができないと言うことができます。
気液平衡
ここで、飽和蒸気圧と関連の深い気液平衡についても説明しておきます。
何度も言っているように、液体の量は蒸気圧が飽和蒸気圧に達した瞬間に変化しなくなります。
しかしだからといって蒸発が止まったということではありません。
ではなぜ水の量が変化しないのでしょうか。それは蒸発している分だけ凝縮が同時に起こっているからです。
そしてこのように蒸発量と凝縮量が釣り合って一見状態変化が止まっているように見える状態を気液平衡と言います。
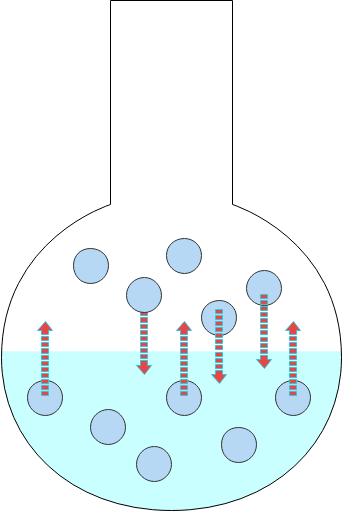
例えばこのモデルでは、3粒蒸発する間に3粒が凝縮しているため、見かけ上は水の量は変わりませんね。
ポイント
気液平衡では、「蒸発量=凝縮量」が成り立つため、見かけ上は蒸発が止まって見える。
蒸気圧曲線とは
では次に飽和蒸気圧曲線について説明していきます。
飽和蒸気圧曲線とはいったいどういうもので、どのよう読み取ればよいのかを見ていきましょう。
蒸気圧曲線の見方
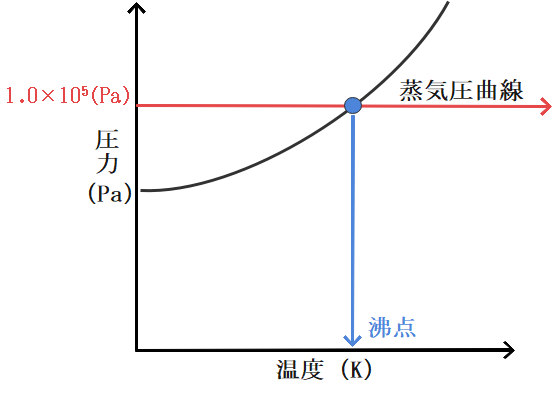
蒸気圧曲線というのは横軸に温度を、縦軸に圧力をとり各温度における飽和蒸気圧を線で結んだものです。
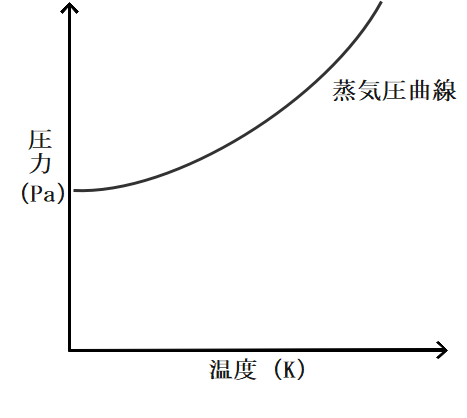
飽和蒸気圧というのは温度に依存しているので、基本的にこのグラフは縦に見ます。
例えば温度が50(K)だとすると、その温度における飽和蒸気圧はP1(Pa)であることがわかりますね。
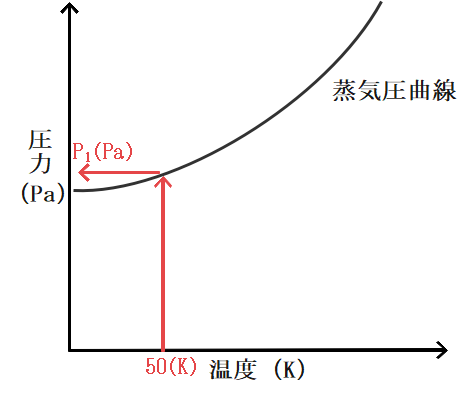
飽和蒸気圧がP1であるということは、蒸気圧が小さいうちは蒸発が進みますが蒸気圧がP1に達した瞬間に気液平衡となり見かけ上蒸発が起こらなくなると言うことができますね。
蒸気圧曲線から沸点を読み取ろう
では蒸気圧曲線の見方がわかったところで蒸気圧曲線から沸点を求める方法をお教えします。
グラフから沸点を求めさせる問題は頻出なのでぜひ覚えておいてください。
ではまずは沸点の定義を確認しておきましょう。沸点とは、液体の蒸気圧が外圧と等しくなる温度のことを言います。
ポイント
沸点とは、蒸気圧と外圧が等しくなる時の温度である。
例えば外圧が1.0×105Paであった場合、蒸気圧が1.0×105Paとなる温度となります。
では今のを例にして実際に沸点をグラフから読み取ってみましょう。
まず外圧が1.0×105Paということは縦軸が1.0×105Pa であるところに注目します。
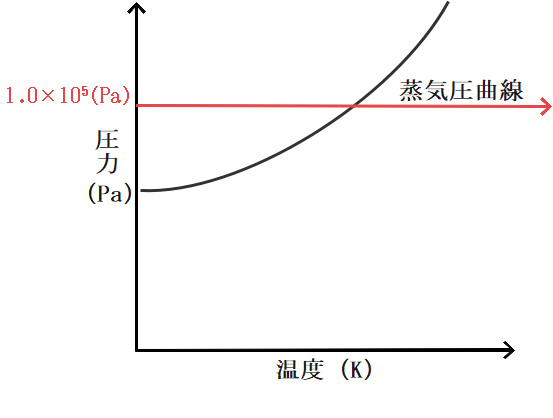
すると、1.0×105Paのところを横に見ていくと蒸気圧曲線と1点で交わることがわかります。
そしてこの点というのがまさに蒸気圧が外圧と一致する点に他なりませんから、その交点の温度を読み取ってあげればそこが沸点となります。
蒸気圧曲線と状態図の関連について
蒸気圧曲線の最後に状態図との関連について少しだけ話しておきます。
化学の状態変化を学習する際にこのような状態図というのを見たことがあると思います。
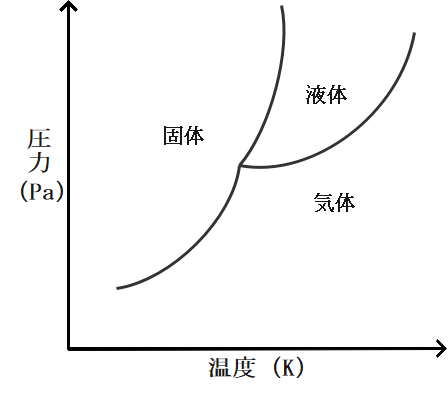
ここに蒸気圧曲線が隠れているのですが知っていましたか。
実は状態図のこの赤い部分がまさに蒸気圧曲線なのです。
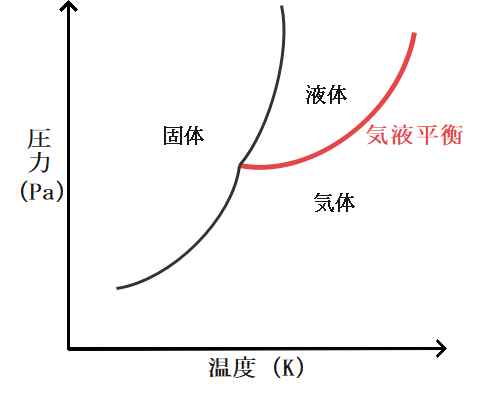
状態図においてこの赤い部分というのは液体と気体の混合状態であると学んだと思いますが、まさにその状態こそ先ほどお教えした気液平衡状態なのです。
状態図とリンクさせて考えると、気体は飽和蒸気圧を超えた蒸気圧をとることはできないという理屈についてより理解が深まるのではないでしょうか。
飽和蒸気圧の計算
ではここからは飽和蒸気圧の計算方法について解説していきます。
飽和蒸気圧に対して苦手意識を持っている人は多いですが、実はワンパターン。
今回お教えする方法を使って簡単に解けるようになってください。
飽和蒸気圧(飽和水蒸気圧)の計算問題の解き方
飽和蒸気圧の問題の解き方は毎回一緒。
次の2ステップを覚えてしまいましょう。
飽和蒸気圧の計算問題の解き方
- すべてが気体と仮定して圧力を計算
- 求めた圧力と飽和蒸気圧を比較する
それぞれのステップについて、それぞれさらに説明していきます。
ステップ1 すべてが気体と仮定して圧力を計算
まずはすべてが気体として仮定し、その場合の蒸気圧を計算します。
ここでは単純に状態方程式を用いて圧力を出しましょう。
ステップ2 求めた圧力と飽和蒸気圧を比較する
そして次にステップ1で求めた圧力を飽和蒸気圧と比較します。
比較の方法は次の通り。
飽和蒸気圧との比較法
求めた圧力Pと飽和蒸気圧Pmaxを比較して次のように圧力を求めます。
- P>=Pmaxの場合 すべてが気体という仮定は誤りなので、求める圧力は飽和蒸気圧Pmax
- P<Pmaxの場合 すべてが気体という仮定は正しいので、求める圧力はP
実はこれだけで気体の圧力は求められてしまうんですね。では次は実際の問題を解いてみましょう。
飽和蒸気圧の問題
今回は一般的な飽和蒸気圧の他に、よく出る水銀柱の問題も扱ってみました。
応用問題として合わせて考えてみてください。
水の飽和蒸気圧
問題
27℃において0.9gの水を2.0Lの容器に入れて密閉した。この時の容器内の気体の圧力を求めよ。
ただし、気体定数を8.3×103、27℃における水の飽和蒸気圧を4.0×103とする。
飽和蒸気圧が関わる問題だとわかったら、まずは全て気体だと仮定します。
つまりここでは0.9gの水が全て気体になっていると考えます。水の物質量は0.9÷18=0.05(mol)ですね。
それではこの仮定の下で水の圧力を計算してみましょう。
状態方程式より、水の圧力をPとして、
P×2.0=0.05×8.3×103×300 ⇔ P=6.2×104(Pa)
そして次のステップが、この計算結果と飽和蒸気圧を比較するというものになります。
今回の場合は6.2×104>4.0×103が成り立ちますね。
ということはもともとの過程が間違っていた、つまり水の一部は液体になっているということがわかります。
したがって、求める圧力は飽和蒸気圧に等しくなりますね。
水銀柱が関わる計算問題の解き方
問題
ガラス管を水銀で満たし倒立させたところ、上部に真空の隙間ができ、水銀柱の高さは760mmとなった。
次に、真空部分に液体の水を入れたところ液体の水が残り、水銀柱の液面が下がった。この時の水銀柱の高さを求めよ。
ただし、この実験は80℃で行われており、80℃における水の飽和蒸気圧は4.7×104Pa、大気圧は1.0×105Paとする。
問題の状況を図示すると次のようになります。
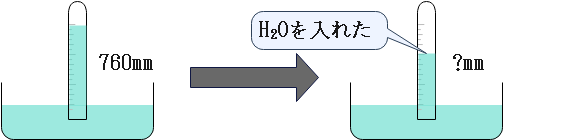
この図の?を求めたらよいわけですね。
ではここで、水銀柱を攻略するポイントをおさらいしておきます。
水銀柱攻略ポイント
水面に対する圧力がどこでも等しい
言葉だけだとわかりにくいかもしれませんね。ここで言っているのは、下の図のようにちょうど水面のところで外気圧と試験管内部の圧力は釣り合っているということです。

ではこれを使って問題を解いてみましょう。まず外気圧は大気圧なので1.0×105Paです。
そして試験管内部の圧力ですが、今回は水銀柱の圧力だけでなく気体の水の蒸気圧も加わるので注意が必要ですね。
ただ、問題文から液体の水が存在しているとわかるので気体の圧力は飽和蒸気圧に等しくなるとすぐにわかります。
あとはこれらの数値を以下の式に代入すると…
水銀柱の圧力+気体の水の圧力=大気圧⇔水銀柱の圧力=1.0×105-4.7×104=5.3×104
意外と水銀柱の解き方がシンプルなことに気が付くと思います。
まとめ
今回は蒸気圧および蒸気圧の関わる問題の解き方を解説しました。
慣れるまでは大変ですが、今回の内容をしっかり理解してもらえればもう怖くはありません!
水銀柱も攻略して、ぜひ周りに差をつけてください。
おすすめ記事












