
酸化還元反応式の作り方がわからない
半反応式の作り方・覚え方を知りたい
今回はこのよう悩みを解決します。
プロフィール

目次
酸化還元反応式の作り方
早速ですが、酸化還元反応式の作り方を見ていきましょう。
結論から言うと流れは毎回一緒です。半反応式を作り、それを組み合わせます。
ここで半反応式というものがでてきたので少し説明しておきます。半反応式とは、酸化還元反応のうち酸化剤あるいは還元剤の片方の反応のみを表したものです。
半反応式には酸化剤または還元剤とその生成物、そして電子が含まれます。具体的には次の例を見てください。
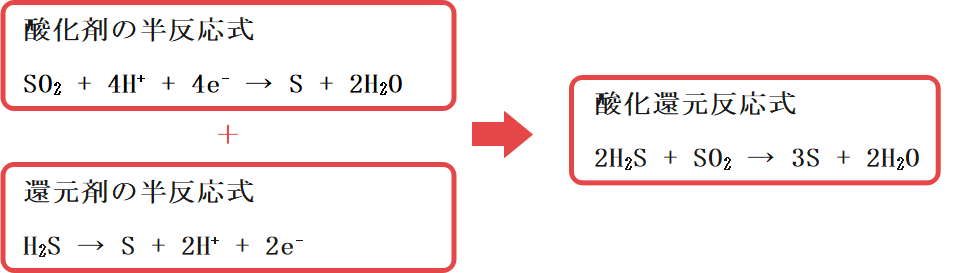
この例からもわかる通り、酸化剤と還元剤のそれぞれについて半反応式を作り、それらを足し合わせることで酸化還元反応を作ることができます。
なお、2つの半反応式の組み合わせ方にはポイントがあります。それは電子がちょうど打ち消されるようにするということです。今の例であれば還元剤の半反応式を2倍して足すことで電子の数がそろいますね。
考えてみれば当然です。酸化還元反応というのは電子のやり取り。一方が出した電子はすべて相手に受け渡されます。
ここまでの内容をまとめると、酸化還元反応の反応式の作り方は次のようになります。
酸化還元反応式の作り方
- 酸化剤と還元剤の名前を覚えておく
- 還元剤が法シュルする電子と酸化剤が受け取る電子がつりあうように半反応式を組み合わせる
しかしここである問題が生じますね。
「反応式は半反応式から作ることができるとは分かったけど、結局半反応式は覚える必要があるのでは」と思われた方はきっと少なくないでしょう。
確かに、全く暗記がいらないということはありません。ただ、暗記量を極力少なくする方法があります。
次章ではその方法について説明していきます。
半反応式の作り方
では早速、半反応式を書くために最低限覚えるべきことは何か説明していきたいと思います。
それは酸化剤とその生成物、あるいは還元剤とその生成物です。言葉だけだとわかりにくいため、具体例を見てみましょう。
過マンガン酸カリウムというのは代表的な酸化剤で半反応式は次のようになります。

そして酸化剤とその生成物というのは四角で囲んだ物質になります。この2つの物質は実際に反応に関わるため、酸化数が変化していますね。
これら2つの物質の化学式さえ押さえておけば半反応式は必ず書けます。半反応式全体を覚えるよりもはるかに覚えることは少なくなるはずです。
ではここからは、酸化剤とその生成物からどのように半反応式を作ればよいのか説明していきます。
まずは左辺に酸化剤を、右辺にその生成物を書きます。
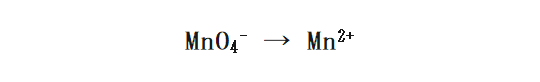
次に、 水(H2O)を加えることで 両辺のOの数を合わせます。今回は右に水を4つ加えればよいですね。
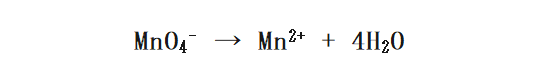
そして今度は水素イオン(H+)によって両辺のHの数を合わせます。今の例では左辺に8つ水素イオンを加えたらいいですね。
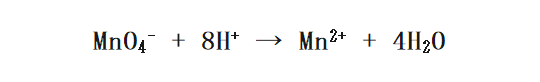
残るは1ステップ。最後は両辺の電荷を電子(e-)によって合わせます。左辺の方が+が5つ分多いですので、電子を5つ加えます。
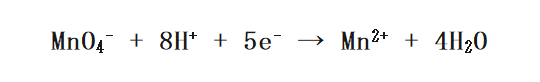
これで最初にあった半反応式が完成しましたね。慣れないうちはとても煩雑な作業をしているように見えるかもしれませんが、何度も繰り返せばいちいち考えなくても半反応式は作れるようになります。
還元剤についても基本的には同様です。
まずはこの4ステップを頭に叩き込みましょう。
半反応式の作り方
- 酸化剤(還元剤)を左辺に、その生成物を右辺に書く
- Oの数をH2Oで合わせる
- Hの数をH+で合わせる
- 電荷をe-で合わせる
半反応式一覧
何度もお伝えしている通り、酸化剤と還元剤およびその生成物はどうしても覚えなければなりません。
そこで最後にそれらをまとめておきたいと思います。ただ、当然よく出るものからあまり出ないものまであるので、「絶対暗記」と「余裕があれば暗記」の2つに分けたのでぜひ参考にしてください。
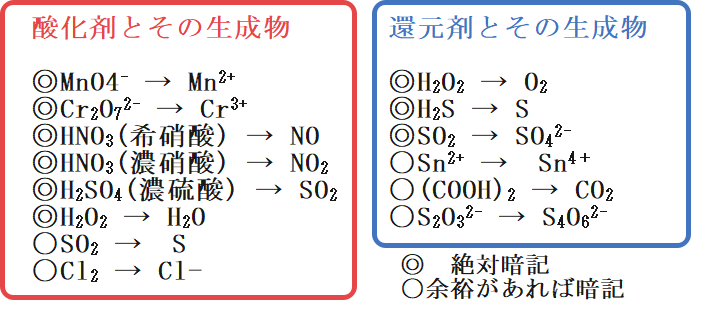
覚えることが多いと感じる方もいるかもしれないですが、これさえ覚えれば酸化還元反応を一瞬で書けるというのも事実です。
毎日反復すれば絶対に1か月で覚えられるので一度本気でやってみてください。
まとめ
今回は酸化還元の反応式をテーマに解説しました。
酸化還元反応の反応式の書き方は次の2ステップです。
- 酸化剤と還元剤の半反応式を覚えておく
- 還元剤が放出する電子と酸化剤が受け取る電子がつりあうように半反応式を組み合わせる
そして半反応式の書き方は次の通りになります。
- 酸化剤(還元剤)を左辺に、その生成物を右辺に書く
- Oの数をH2Oで合わせる
- Hの数をH+で合わせる
- 電荷をe-で合わせる
これらの方法が使えれば、酸化剤と還元剤及びその生成物さえ覚えておけばよいのでしたね。
今回の内容を繰り返して酸化還元を得点源にしてしまってください。
おすすめ記事













