
気体の発生法に何があるか知りたい
気体の発生法ぼ具体的な反応式について知りたい
今回はこのような悩みを解決します。
高校化学で覚えておくべき気体の発生法について網羅的に仕組みから解説しているので、ぜひ活用しください。
プロフィール

目次
高校化学で覚えるべき気体の発生法一覧
高校化学で覚えるべき気体の発生法は次の通りです。
気体の発生法一覧
- 水素の発生
- 窒素の発生
- 酸素の発生
- 塩素の発生
- 一酸化炭素の発生
- 二酸化炭素の発生
- 一酸化窒素の発生
- 二酸化窒素の発生
- アンモニアの発生
- 塩素の発生
- 硫化水素の発生
- メタンの発生
化学反応式および反応機構
ここからはそれぞれの反応について、化学反応式および反応の仕組みを解説していきます。
H2(水素)の発生
水素は亜鉛を硫酸に入れることで発生させることができます。
水素の発生
Zn + H2SO4 → ZnSO4 + H2
この反応はイオン化傾向によって起こります。
ZnとHのイオン化傾向を比較するとZnの方が大きいですね。したがって、水中にZnとH+が存在すると電子がZnからH+に移動するため、水素が発生します。
ただ、水素は水の電気分解などほかの反応でも生じるので知っておきましょう。
N2(窒素)の発生
窒素は亜硝酸アンモニウムの熱分解によって発生させることができます。
窒素自体は知っていても、発生法は意外と知っている人は少ないですね。
窒素の発生
NH4NO2 → N2 + 2H2O
ここで亜硝酸アンモニウムという物質が出てきましたが、亜というのは酸素が1つ少ないということを指しています。
一般的に硝酸イオンはNO3-ですがここで出てきたのはそこから酸素が1つ減った亜硝酸イオンNO2-になります。
亜塩素酸なども有名ですね。
O2(酸素)の発生
酸素の発生法は2つ覚えておきましょう。なお、酸素の発生法においてはいずれも触媒として酸化マンガンが使われることも重要です。
1つ目は過酸化水素水の分解になります。
酸素の発生1
2H2O2 → 2H2O + O2
この反応は酸化還元反応になります。ただし、過酸化水素が酸化剤にも還元剤にもなるという珍しい反応ですね。
酸化還元についてはこちらもあわせて理解してください。
そして2つ目の反応が塩素酸カリウムの熱分解になります。
酸素の発生2
2KClO3 → 2KCl + 3O2
過酸化水素水の分解がよく出るので忘れられがちですが、マーク試験で急に聞かれたりするので覚えておきましょう。
Cl2(塩素)の発生
塩素は酸化マンガンと塩化水素から発生します。
塩素の発生
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
この反応は酸化還元反応になります。酸化マンガンが酸化剤として働いていますね。
そしてこの反応式は頻出です。というのも、実験装置が特徴的だからです。
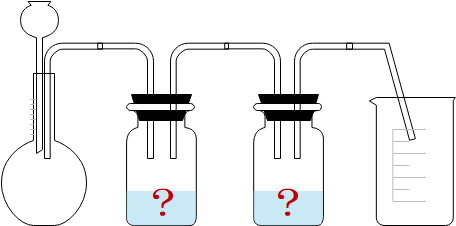
この図のように、発生した塩素は2つの液体を通して回収されます。
さて、ここで問題になってくるのが液体はそれぞれ何なのかということですね。よく聞かれるので覚えておきましょう。
実験の注意点
塩素の発生実験では、水→濃硫酸の順番に液体に通す
なぜ液体に通す必要があるのでしょうか。それは、純粋な塩素を得るためです。
実は最初に出てくる気体には塩素の他に塩化水素(HCl)と水(H2O)も含まれているんですね。それらを取り除かなくてはなりません。
2つの液体のうち、最初の水は塩化水素を吸収する役割、2つ目の濃硫酸は水を吸収する役割を担っています。
液体の役割
水…塩化水素(HCl)を吸収する
濃硫酸…水(H2O)を吸収する
そしてこの実験には注意点がもう一つあります。
それは、液体の順番を逆にしてはいけないということです。
なぜなら水を2番目にした場合、蒸発した水が塩素とともに回収されてしまうからですね。
CO(一酸化炭素)の発生
一酸化炭素の発生法は結構マイナーなので、余裕がある人だけ覚えておきましょう。
一酸化炭素の発生
HCOOH→CO +H2O
この実験では濃硫酸を使います。
濃硫酸の脱水作用を利用して、ギ酸から一酸化炭素が作られます。
CO2(二酸化炭素)の発生
二酸化炭素の発生法はいくつかあります。
最も有名なのは弱酸の遊離を利用した方法になります。
二酸化炭素の発生1
CaCO3 + 2HCl → CaCl2 + H2O + CO2
二酸化炭素の塩である炭酸カルシウムに強酸の塩化水素を加えることで弱酸である二酸化炭素が遊離します。
そして皆さんには次の発生法も覚えて欲しいと思います。
二酸化炭素の発生2
CaCO3 → CaO + CO2
これは炭酸カルシウムの熱分解になります。
アンモニアソーダ法において出てくる反応なので、そこと合わせて覚えておきましょう。
NO(一酸化窒素)の発生
一酸化窒素の発生法は次の通りです。
一酸化窒素の発生
3Cu + 8HNO3 → 3Cu(NO3)2 + 4H2O + 2NO
これは酸化還元反応になります。銅と酸化剤の希硝酸を使うことで一酸化窒素が得られます。
この反応のポイントは希硝酸を使う点です。というのも、希硝酸ではなく濃硝酸を使った場合は次の二酸化窒素(NO2)が発生してしまうからです。
また、一酸化窒素の発生の化学反応式はトップクラスで問われます。
難関大以上を目指している人は反応の係数を丸暗記してしまいましょう。
NO2(二酸化窒素)の発生
続いて二酸化窒素の発生法を紹介します。
二酸化窒素の発生
Cu + 4HNO3 → Cu(NO3)2 + 2H2O + 2NO2
ここで使われる硝酸は濃硝酸になります。そして反応の仕組みは酸化還元反応ですね。
これも先ほどの一酸化窒素同様頻出ですので、すぐに反応式を書けるようにしておくとよいでしょう。
SO2(二酸化硫黄)の発生
二酸化硫黄の発生法は次の通りです。
二酸化硫黄の発生
Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
この反応も酸化還元反応です。したがって、普通の硫酸ではなく濃硫酸が使われます。
一酸化窒素、二酸化窒素に比べると頻度は劣りますが、テストで出る可能性は高いですね。
NH3(アンモニア)の発生・ハーバーボッシュ法
アンモニアの発生法はハーバーボッシュ法と呼ばれます。
反応式は次の通りです。
アンモニアの発生(ハーバーボッシュ法)
N2 + 3H2 → 2NH3
反応式自体はいたってシンプルですが、反応の条件が非常に厳しくなっています。
というのも、一般的には高温にするほど反応というのは速く進むのですが、アンモニアの発生は吸熱反応であるため、高温のしすぎると逆に効率が悪くなってしまうからです。
この難しさゆえにわざわざ名前がついているのでしょうか。
この条件については記述で聞かれることがあるので対策しておきましょう。
HCl(塩素)の発生・揮発性と不揮発性
塩化水素の発生法は次の通りです。
塩化水素の発生
NaCl + H2SO4 → NaHSO4 + HCl
一見すると反応機構がわかりにくいですよね。
実は揮発性の酸の塩+不揮発性の酸によって揮発性の酸が遊離することが知られており、今回はその性質を利用しています。
揮発性とは気体になりやすい性質のことですね。
ただし、反応の仕組みが聞かれることはないため、塩化ナトリウムと濃硫酸を混ぜると塩素が発生するという事実を知っておくだけでも十分です。
H2S(硫化水素)の発生
硫化水素の発生法は次のようになります。
硫化水素の発生
FeS + H2SO4 → FeSO4 + H2S
硫化水素は弱酸ですから、弱酸の遊離を利用しています。
CH4(メタン)の発生
最後にメタンの発生法をご紹介します。
意外な組み合わせのため、盲点になりやすいので注意しましょう。
メタンの発生
CH3COONa + NaOH → CH4 + Na2CO3
なんとメタンは酢酸ナトリウムと水酸化ナトリウムを混合することで発生させることができます。
酢酸ナトリウムと水酸化ナトリウムと言えば緩衝液ですが、今回は2つとも固体を反応させるのでメタンが発生するようになります。
ちなみにこの反応は脱炭酸反応と呼ばれています。
まとめ
今回は高校化学の範囲で知っておくべき気体の発生法をまとめました。
この量の反応を覚えるにはひたすら反復するしかありません。ぜひ頑張ってください。
おすすめ記事













