
熱化学方程式の計算問題が解けない…

エネルギー図や結合エネルギーって何なの?
こんな悩みを抱えてはいませんか。
熱化学方程式の分野はできる人とできない人の差が非常に大きくなる傾向があります。
熱化学方程式をちゃんと理解する人はほとんどの問題は一瞬で解けてしまうんですよね。
そんなの自分には無理…。
そう思っている方、諦めるのはもったいないですよ!
というのも熱化学方程式は覚えることが少ない割に簡単に満点が狙える分野でもあるからです。
非常にコスパがいいんですよね。
そこで今回は熱化学方程式が苦手だという人に向けて、熱化学方程式のすべてを解説します。
今回の内容を理解してもらえれば間違いなく熱化学方程式に苦しむことはなくなります。
少し長いですが、ついてきてください!
プロフィール

目次
熱化学方程式とは
まずは熱化学方程式とは何かを押さえておきましょう。
熱化学方程式とは、一言で言うと化学反応に伴う熱の変化を表したものとなります。
つまり表しているのは化学反応自体というわけではなく、あくまでもそれに伴う熱の出入りだということ。
例えば下の熱化学方程式を見てください。
\(C(黒鉛)+O_{2}(気体)=CO_{2}(気体)+394kJ\)
これは黒鉛と酸素から二酸化炭素が生成する場合は394kJの熱が発生するという意味になります。
熱化学方程式と化学反応式の違い
そして熱化学方程式で大切なポイントは化学反応式との違いです。
その違いは主に書き方の違いであり、異なる点は2つあります。
熱化学方程式か化学反応式違い
- 化学反応式では「→」を使うが、熱化学方程式では「=」を使う
- 各物質の状態を明記する
それではそれぞれについてもう少し詳しく説明していきます。
化学反応式では「→」を使うが熱化学方程式では「=」を使う
違い1つ目は「=」を使うという点。
テストではついうっかりいつもの癖で「→」と書いてしまいがち。これは熱化学方程式を書く問題において最も多くみられるミスになります。
したがって、熱化学方程式は「=」を使うんだということは絶対に忘れないようにしておきましょう。
一応なぜ「=」を使うのかを説明しておきますが、ここは理解する必要がないので興味のない人は飛ばしてください。
「=」を使う理由。それは熱化学方程式は両辺のエネルギーが等しいということを表しているからです。
これはエネルギー図を使うことでより理解しやすくなります。
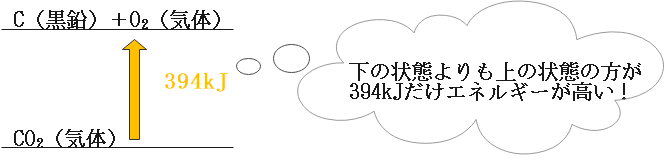
この図のように、炭素(C)と酸素(O2)の状態というのは二酸化炭素(CO2)の状態に比べて394kJエネルギー的に高くなっているんですよね。
したがって、二酸化炭素に394kJを加えることでエネルギー的に釣り合うことになりますよね。
それを表したのが先ほどの熱化学方程式になります。
\(C(黒鉛)+O_{2}(気体)=CO_{2}(気体)+394kJ\)
熱化学方程式では物質の状態を明記する
違い2つ目は物質の状態を明記するということですね。
先ほどの熱化学方程式ではCは黒鉛、O2は気体、CO2は気体であることが書いてあると思います。
なぜ状態を明記する必要があるのか。それは同じ物質であっても状態によってエネルギーが異なってくるからです。

例えば水について考えてみましょう。
同じH2Oであっても、液体の水と気体の水では状態が異なりますよね。そしてこれら2つの場合は液体の状態よりも気体の状態の方がよりエネルギーが高くなっています。
したがって、仮にH2Oと書いただけの場合どのエネルギー状態にいるのかが不明瞭なので正確に熱化学方程式を書くことができません。
これが理由で物質の状態を明記することが求められています。
ヘスの法則をわかりやすく解説
さて、熱化学方程式については理解していただけたと思うので解き方を説明したいのですが、その前にもう一つ知っておくべきことがあります。
それがヘスの法則です。なぜヘスの法則が大事かというと、これから説明する熱化学方程式の解き方の前提になっているからです。
ヘスの法則が成り立つからこそ簡単な解法が存在するんですね。
ただヘスの法則自体、そこまで難しいものではないのでサクッと説明してしましましょう。
ヘスの法則とは、「反応熱は反応の経路によらず、反応前と反応後の物質の状態によって決まる」というものになります。
ヘスの法則…反応熱は反応の経路によらず、反応前と反応後の物質の状態によって決まる
例えば先ほどの熱化学方程式について考えてみましょう。
\(C(黒鉛)+O_{2}(気体)=CO_{2}(気体)+394kJ\)
これは黒鉛と酸素から二酸化炭素が作られるとき、394kJの熱が放出されることを表しています。
では反応経路を変えてみましょう。
黒鉛と酸素からまずは一酸化炭素を作ります。そしてその一酸化炭素を酸化することで二酸化炭素を作ったとします。
この場合、反応全体としての熱の出入りはどうなるでしょうか。それぞれの熱化学方程式は次のようになります。
\(C(黒鉛)+\frac{1}{2}O_{2}(気体)=CO(気体)+111kJ\)
\(CO(気体)+\frac{1}{2}O_{2}(気体)=CO_{2}(気体)+283kJ\)
今求めたいのは反応全体としての熱の出入りですが、それは2つの反応熱を足してあげればよいので111+283=394(kJ)となります。
もうお気づきかもしれませんが、この値は先ほどの二酸化炭素の生成熱と一致していますね。
このように、反応熱は実は経路は関係ないというヘスの法則が成り立つのです。
熱化学方程式の解き方~公式を暗記せよ~
さあここからが本題ですね。熱化学方程式の解き方を解説していきます。
章のタイトルにも書きましたが、熱化学方程式の解法はいたってシンプル。
公式を覚えるだけです。ではその公式を紹介しましょう。
熱化学方程式の解法は大きく分けて2つあります。
1つ目は生成熱を使った公式、2つ目は結合エネルギーを使った公式になります。
2つあるのか…と思った方も安心してください。2つの公式は見た目こそ違いますが本質的には同じです。
その公式は次の通りです。
公式1 生成熱のパターン
反応熱Q=(生成物の生成熱の和)ー(反応物の生成熱の和)
公式2 結合エネルギーのパターン
反応熱Q=(生成物の結合エネルギーの和)ー(反応物の結合エネルギーの和)
どうでしょうか。ようは何をしたらよいかというと、反応後から反応前を引いたらいいんですよね。
そのように覚えてもらって構いません。
公式を使って実際に解いてみよう
では本当に先ほどの公式が使えるのかどうか、実際の問題を通して確認してみましょう。
1.生成熱の問題
問題
黒鉛の燃焼熱が394kJ/mol、水素の燃焼熱が286kJ/mol、プロパンの燃焼熱が2220kJ/molであるとき、プロパンの生成熱を求めよ。
まずは計算の前に熱化学方程式を書く必要がありますね。
今回はプロパンの生成熱を求めるので、プロパンの燃焼反応を書きます。
\(C_{3}H_{8}(気体)+5O_{2}=3CO_{2}(気体)+4H_{2}O(気体)+2220kJ\)
先ほど述べた注意点は守れたでしょうか。
「→」ではなく「=」を使い、かつ物質の状態を明記するのでしたね。そして今回はこの反応の反応熱は2220kJと与えられているので初めから書くことができます。
ここまできたらあとは公式にぶち込むだけです。ただし、ここでもう1ステップ踏む必要があります。
というのも、この熱化学方程式の各物質の生成熱がわからないからです。
公式では生成熱の和をとりますが、そもそも生成熱がわからない場合は計算ができませんよね。
ではどのように生成熱を求めるのか。実はこれは非常に簡単。
与えられているのは黒鉛と水素の燃焼熱ですね。これらの熱化学方程式を書いてみましょう。
\(C(黒鉛)+O_{2}(酸素)=CO_{2}(気体)+394kJ\) …①
\(H_{2}(気体)+\frac{1}{2}O_{2}(気体)=H_{2}O(液体)+286kJ\) …②
このように熱化学方程式を書いてみると、実はこれら2つの反応熱はそれぞれ二酸化炭素の生成熱、水の生成熱と読み替えられることに気が付きませんか。
そう。実は燃焼熱を与えられていますが、これは自分で生成熱と言い換えることができるんです。
熱焼熱として与えられていても生成熱と読み替えられる場合がある
すると二酸化炭素の生成熱は394kJ、水の生成熱は286kJですから、あとは公式に代入すると…
解答
反応熱=(生成物の生成熱の和)ー(反応物の生成熱の和)より、プロパンの生成熱をQとすると
2220=(3×394+4×286)ーQ ⇔ Q=106
どうでしたか。
燃焼熱を生成熱に読み替えるところがポイントになりますが、計算自体は公式を使うとすぐにできてしまいますよね。
2. 結合エネルギーの問題
問題
\(N_{2}\)の結合エネルギーを942kJ、H-Hの結合エネルギーを432kJとする。
アンモニアの生成熱が46kJのとき、N-Hの結合エネルギーを求めよ。
さて、次は結合エネルギーが出てくる問題です。
結合エネルギー自体が難しいので、おそらく苦手意識がある人が多いのではないでしょうか。
でも公式を知っているみなさんなら簡単に解けてしまいますよ。
まずは先ほど同様、熱化学方程式を書きます。アンモニアの生成熱が与えられているのでアンモニアの生成反応を書きましょう。
\(\frac{1}{2}N_{2}(気体)+\frac{3}{2}H_{2}(気体)=NH_{3}(気体)+46kJ\)
ここまで来たらあとは公式に代入するだけです。
解答
反応熱=(生成物の結合エネルギーの和)ー(反応物の結合エネルギーの和)より、N-Hの結合エネルギをXとおくと、
\(46=3X-(\frac{1}{2}×942+\frac{3}{2}×432) ⇔ X=338.5\)
結合エネルギーが苦手な人であっても、公式さえ使えれば簡単に計算できることが分かったと思います。
まとめ
今回は熱化学方程式の解き方として、2つの公式をご紹介しました。
公式1 生成熱のパターン
反応熱Q=(生成物の生成熱の和)ー(反応物の生成熱の和)
公式2 結合エネルギーのパターン
反応熱Q=(生成物の結合エネルギーの和)ー(反応物の結合エネルギーの和)
複数の熱化学方程式を足し引きする解法やエネルギー図を使った解法もありますが、個人的には今回の方法がもっとも速く簡単に解けると思います。
公式さえ覚えてしまえばあなたも熱化学方程式マスター。ぜひ使ってみてください!











