
強酸(強塩基)のpHの求め方がわからない
pH計算って複雑ですよね。歩兵も「答えがあっている気がしない」と思いながらpH計算をすることがよくありました。
しかし実は、強酸(強塩基)のpHはポイントさえ押さえれば非常に簡単です。
今回はそのポイントについて解説していきます。
最後まで読んでいただければ強酸(強塩基)のpHなんてすぐに求められるようになりますよ。
なお、強塩基のpHの求め方は本質的には強酸のpHの求め方と一緒であるため、強酸にしぼって解説していきます。
プロフィール

目次
強酸のpHの求め方
早速ですが、強酸のpHの求め方を紹介します。
pHを求めるには先に水素イオン濃度を求める必要がありますね。
では水素イオン濃度はどのように求めたらよいでしょうか。
ここで重要なのが強酸の性質です。
強酸というのは電離度がほぼ1に近いです。つまり、ほとんどが電離します。
例えば強酸の1つ、塩酸について考えてみましょう。
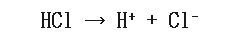
塩酸はこのように電離します。そして強酸であるため、塩酸が1molあったとすると水素イオンも1mol生成されることになりますね。
したがって、水素イオン濃度は基本的には以下のようになります。

強酸のpHは価数に注意せよ
先ほど「基本的には以下のようになる」と述べたのにお気づきでしょうか。
そうです。いつでも水素イオン濃度が強酸の濃度に一致するとは限らないんですよね。
どういうことかというと、強酸の価数に注意しなければならないということです。
先ほどの例の塩酸は1価の酸だったので価数を気にしなくてもよかったのですが、2価や3価の酸では価数の分を考慮する必要があります。
2価の強酸である硫酸について考えてみましょう。
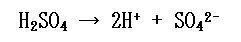
硫酸はこのように電離します。強酸なので電離度は1ですね。
では硫酸が1molあるとしましょう。すると水素イオンは何molになるでしょうか。
電離式から、水素イオンは2mol生成することがわかりますね。
一般的に強酸は価数の分だけ水素イオンを放出します。今回であれば2価の強酸なので水素イオンは2倍になっているわけですね。
したがって価数を含めて考えると、強酸の水素イオン濃度は次のようになります。

以上のことをまとめると、強酸のpHは次のようになると言えますね。

強酸のpHを実際に求めてみよう
では最後に復習もかねて実際のpH計算問題を解いてみましょう。
一般的な強酸のpH
まずはオーソドックスな問題です。
問題1
5.0×10-2(mol/L)の硫酸のpHを求めよ。今回は硫酸。2価の強酸ですからね。正しくは価数も考えて次のようになります。
問題1解答
硫酸は2価の強酸より、[H+]=2×5.0×10-2=1.0×10-1 したがって求めるpHは、pH=-log101.0×10-1=1中和反応と強酸のpH
先ほどよりも少し発展的です。ぜひトライしてみてください。
問題2
5.0×10-2(mol/L)の硝酸が300mLある。ここに5.0×10-2(mol/L)の水酸化ナトリウムを200mL加えたときのpHを求めよ。化学において反応が出てきたら反応式および物質収支を書くのが原則です。
まず化学反応式は次のようになります。
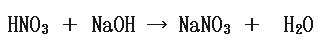
次に、硝酸と水酸化ナトリウムの物質量を計算します。
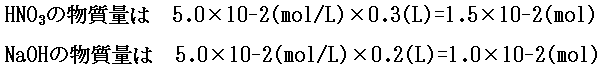
これらをもとに物質収支を考えてみましょう。
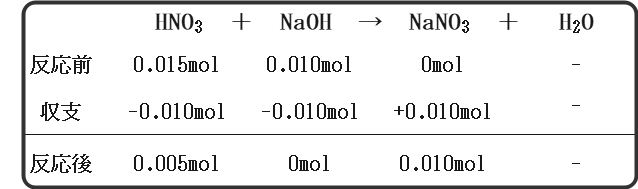
これより、中和後の水溶液には硝酸が0.005mol含まれていることになりますね。
ただし、ここで注意して欲しいのが水溶液の体積です。2つの溶液を合わせているので水溶液は500mLになります。
以上のことから、求めるpHは次のようになります。
問題2解答
硝酸の濃度は、0.005(mol)÷0.5(L)=1.0×10-2(mol/L) 硝酸は1価の強酸より、[H+]=1.0×10-2(mol/L) したがって求めるpHは、pH=-log101.0×10-2=2まとめ
今回は強酸のpHの求め方について解説しました。
今回の内容を完璧に理解して、次試験で出てきたときにはがっつり得点ししちゃってください。
なお、pHは強酸だけではありませんね。弱酸や緩衝液のpHも計算できるようにならなければいけません。
他のpH計算についてはこちらをご覧ください。
おすすめ記事














